Proyecto

Línea de investigación:
El hueso humano es un material compuesto sustentado sobre una matriz inorgánica (hidroxiapatita), un polímero orgánico (colágeno) y agua, formando una estructura compleja y de porosidad jerárquica. La morfología del hueso está compuesta por el hueso trabecular, y presenta densidades de 0.3 a 1.1 g/cm3 y se encuentra rodeado del hueso cortical, con una densidad ~1.8 g/cm3.
Los biomateriales aplicados a la regeneración ósea deben favorecer la adhesión de las células formadoras del hueso, los osteoblastos, la neogénesis de matriz mineralizada, y la formación de nuevo tejido óseo. El adecuado diseño de una topografía de superficie en un biomaterial puede influir en la capacidad de las células para adherirse en la interfase célula-sustrato favoreciendo la adhesión y diferenciación osteoblástica y una mejor reparación tisular [1-6]. La calidad de la adhesión celular inducida por las características fisicoquímicas del biomaterial influye en la morfología, la capacidad de proliferación y la diferenciación celular. Por tanto, el material empleado debe ser capaz de reclutar osteoblastos y estimular su diferenciación para sintetizar matriz con capacidad de calcificarse [4-6].
En general, las propiedades clave de los biomateriales aplicados en la regeneración ósea son:
- Biocompatibilidad: capacidad para acoger la actividad celular fisiológica, incluyendo la capacidad de reclutar células progenitoras (osteoinducción), la capacidad de inducir la formación de nuevo tejido óseo (osteoconducción) y la de formación de vasos (angiogénesis) . .
- Biodegradabilidad: el biomaterial ideal debería degradarse a una velocidad controlada, permitiendo que el nuevo tejido ocupe su espacio. Además, la existencia de poros interconectados (porosidad) es un factor clave en el diseño de los biomateriales diseñados como andamios (scaffolds). Para permitir la difusión de los nutrientes esenciales, deben interconectarse y alcanzar tamaños en torno a 100 µm. Para favorecer la angiogenesis se recomienda un tamaño de poro que entre 50 y 500 µm.
- Resistencia mecánica: como soporte, los scaffolds deben contar con una adecuada estabilidad mecánica que resista el procedimiento de implantación, así como resistir al colapso durante las actividades normales del paciente. La resistencia del scaffold debe ser similar a la del hueso receptor.
Dentro de los biomateriales más utilizados actualmente se encuentran los andamios naturales de colágeno, quitosano y resinas compuestas que han demostrado ser osteoconductivos, aunque presentan una escasa integridad mecánica. Los geles han sido ampliamente estudiados para una infinidad de aplicaciones como materiales puros o híbridos, dado que la funcionalidad de las fases añadidas abre múltiples caminos para muy diversas aplicaciones [11-14], y, en concreto, para posibles biomateriales basados principalmente en la sílice [15-16]. Una de las ventajas del método reside en que las propiedades de los geles híbridos pueden ser ajustadas mediante la elección apropiada de las fases constituyentes y controlando su contenido relativo.
Por otra parte, la adición de polímeros orgánicos a la estructura en cantidades controladas permite ajustar las propiedades mecánicas de estos aerogeles híbridos bioactivos, que pudieron ajustarse a las del hueso trabecular humano (10-200 MPa de módulo elástico). Para cumplir los criterios de porosidad, los andamios sintéticos deben poseer una red de poros interconectados [17] para lo que se ha propuesto la combinación de la tecnología sol-gel con la de obtención de estructuras poliméricas porosas mediante espumeo, para obtener biomateriales basados en vidrios bioactivos u otras como gel casting, disolución y colada con liberación de partículas, laminación de membranas, separación de fases, saturación con gas, espumado con alta presión y liberación de partículas.
Resultados previos publicados, además de estudios no publicados, por el equipo de investigación constatan la obtención de aerogeles híbridos que satisfacen varios de los requisitos de los biomateriales, como la resistencia mecánica [7-14] constatándose la precipitación de la hidroxiapatita tras varios días de inmersión en el fluido corporal simulado; y la bioactividad, mediante la valoración de la adhesión, el reclutamiento y la proliferación de células osteoblásticas [4-6].
,
 SEM micrographs of a Silica/Chitosan aerogel fracture surface and the growth of spherical hydroxyapatite crystals on the surface.
SEM micrographs of a Silica/Chitosan aerogel fracture surface and the growth of spherical hydroxyapatite crystals on the surface.
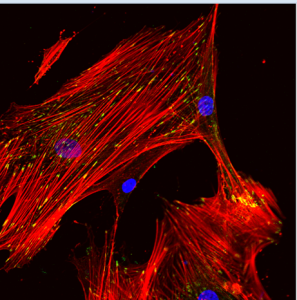
Fluorescence microscopy images of Human Osteoblast: actin filaments (red), vinculin (green) and nucleus (blue).
- M Salido, JI Vilches, JL Gonzalez, J Vilches. Mithocondrial bioenergetics and distribution in living human osteoblasts grown on implant surfaces. Histol.Histopathol. 2009, 1275-1286.
- Terriza A, Díaz-Cuenca MA, Yubero F; Barranco A; González-Elipe AR; Gonzalez JL; Vilches J; Salido M. Light induced hydrophilicity and osteoblast adhesion promotion on amorphous TiO2. Journal of Biomedical Material Research Part A. 2013, 101A: 1026-1035.
- A Terriza, JI Vilches, JL González, E Orden, F Yubero, A Barranco, AR Gonzalez-Elipe, J. Vilches, M. Salido. Osteoblasts Interaction with PLGA Membranes Functionalized with Titanium Film Nanolayer by PECVD. In vitro Assessment of Surface Influence on Cell Adhesion during Initial Cell to Material Interaction. Materials 2014, 7: 1687-1708
- A Terriza, JI Vilches, E Orden, FYubero, JL Gonzalez, AR González-Elipe, J.Vilches, M Salido. Osteoconductive potential of barrier nanoSiO2 PLGA membranes functionalized by Plasma Enhanced Chemical Vapour deposition. BMRI 2014, ID 253590.
- M Salido,JIVilches,JVilches.Simultaneous fluorescence and reflection confocal microscopy study of living osteoblast bioenergetics as a tool for the design of surface topography of dental implants. In: Kaminski, DuPois Eds, Dental Material Research. Nova Science Publ. NY 2009, 61-82.
- Ng J, Spiller K,Bernhard J, Vunjak G.Biomimetic Approaches for BoneTissue Engineering.Tissue Eng B:Rev 2017, doi:10.1089/ten. teb.2016.0289.
- Mechanical Testing of Bone and the Bone Implant Interface. YH An and RA Draughn, Eds. CRC Press. 2000.
- JA Toledo, R. Mendoza, A Santos, M. Piñero, N De la Rosa Fox et. al. Improvement of the Bioactivity of Organic-Inorganic Hybrid Aerogels/ Wollastonite Composites With TiO2. J. Sol-Gel Sci. Technol. 2008, 45: 261267.
- L Esquivias, V Morales, M Piñero, N De la Rosa Fox. Bioactive Organic-Inorganic Hybrid Aerogels. En: Organic/Inorganic Hybrid Materials-2004. Warrendale, Pensilvnia, EE.UU. Materials Research Society. 2005. ISBN 1-55899-795-4
- N de la Rosa-Fox, V Morales, JA Toledo, M Piñero, R Mendoza-Serna, L Esquivias. Nanoindentation of hybrid organic/inorganic silica aerogels. J.Eur.Ceram.Soc 27, 3311–3316. (2007).
- A.Santos, M Ajbary, A Kherbeche, M Piñero, N De la Rosa Fox, L Esquivias. Fast CO2 Sequestration by Aerogel Composites. J. Sol-Gel Sci. Technol. 45,2008: 291-297
- V Morales, A Santos, L Esquivias. Recent insights into xerogel and aerogel mineral composites for CO2 mineral sequestration, J Sol-Gel Sci Technol. 59,2010, 417423.
- V Morales, N De la Rosa Fox, M Piñero, L Esquivias. Hybrid Aerogels and Bioactive Aerogels Under Uniaxial Compression: an in Situ Saxs Study. Rev Metalurg. 2010. 46: 143-148
- V Morales, M Piñero, V Braza, MM Mesa, L Esquivias, N De La Rosa-Fox. Absorption capacity, kinetics and mechanical behavior in dry and wet states of hydrophobic DEDMS/TEOS-based silica aerogels. J Sol-Gel Sci Technol 2017, 81: 600-610.
- JA Toledo, R Mendoza, V Morales, N De La Rosa-Fox, M Piñero, et al. Bioactivity of wollastonite/aerogels composites obtained from a TEOS- MTES matrix. J Mater Sci- Mater. Med.2008,19: 2207-2213.
- N Annabi, J Nichol, X Zhong, et al. Controlling the Porosity and Microarchitecture of Hydrogels for Tissue Engineering. Tissue Eng B:Reviews. 16, 2010: 371-383.
- Almeida HA, Bártolo PJ. Design of tissue engineering scaffolds based on hyperbolic surfaces: Structural numerical evaluation. Med Eng Phys, 36, 2014,1033–1040.

